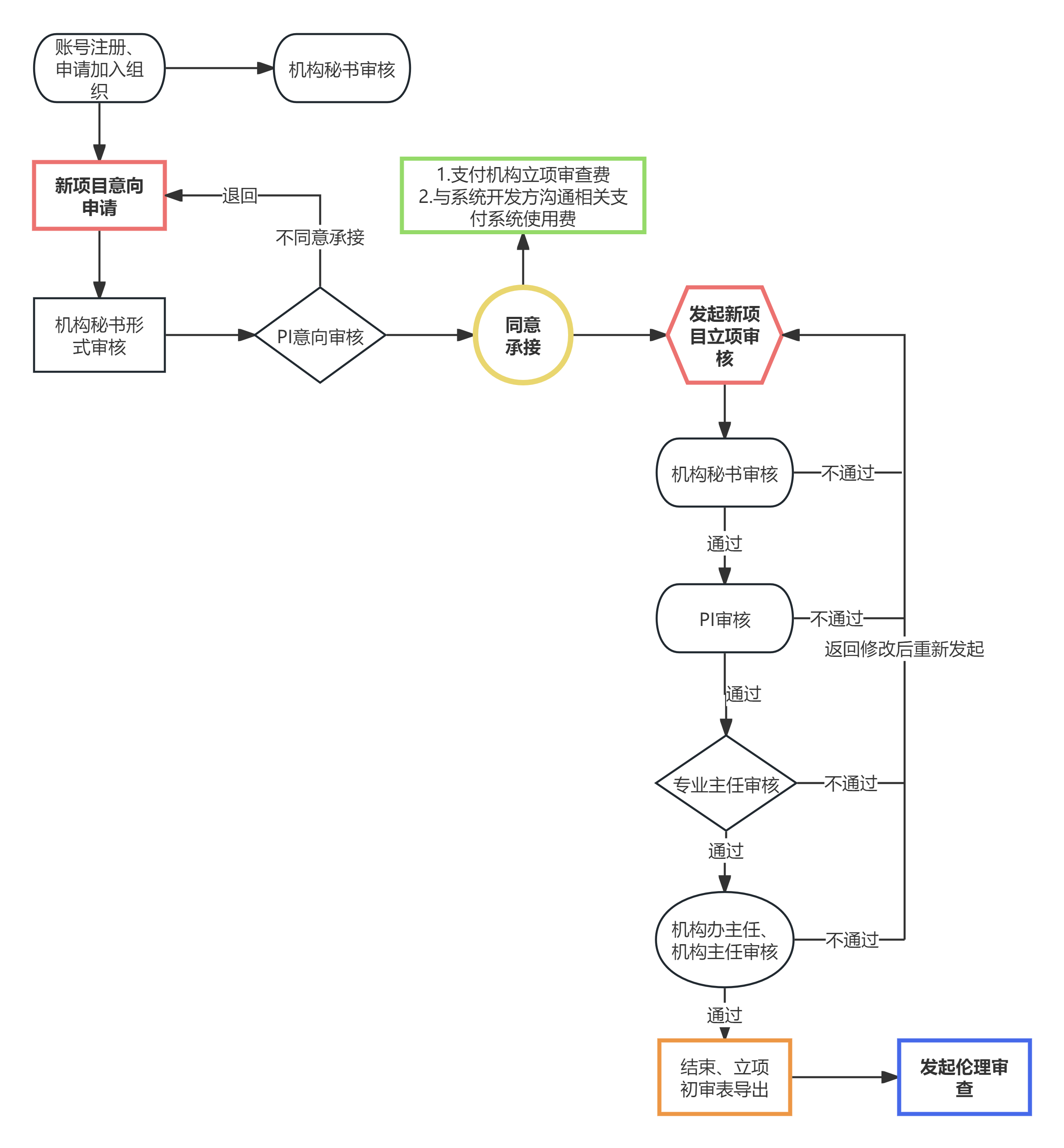
1.新项目请发送项目简要信息至机构邮箱([email protected]),文字内容包括但不限于:
1)方案名称
2) 申办方
3) CRO及SMO(若有)
4) 组长单位
5) 主要适应症,相关要求
6) 现进展,本中心预计承接例数
7)意向开展科室,意向PI等
注:请勿发送任何附件。
捷克论坛 备案PI查询://jkfforum.com/index.php?id=6024(药物);//jkfforum.com/index.php?id=6025(医疗器械)
2.新项目立项(意向)审核:
1)机构CTMS系统网址://ctms.tonoinfo.com。
2)若前期沟通未确认PI意向,可发起意向审核,若已确认意向的可直接发起机构立项审核。
3)立项完成后机构纸质资料(1套)可同伦理纸质资料一并递交(天心阁院区综合楼504),注意装订要求及侧标签。
提醒:
1)本中心可接受暂无组长单位批件进行相关立项工作,但若无国家局批准通知书的须公司出具相关说明。
2)根据伦理要求排队进行伦理审核(立项成功后点击项目递交伦理审核,伦理会频次每月至少一次)。
2)立项成功后可于CTMS系统同步发起“主合同审查”(主协议和CRC三方协议),协议初审(本院模板及非本院模板)意见于1-2个工作日内于CTMS系统反馈(Clean版),初审通过后协议向上审查一周内回复结果,终版协议签署时长:5个工作日,具体流程://jkfforum.com/index.php?id=5061。
3)遗传资源审查及承诺书签署,请与机构办秘书确认材料,承诺书与终版主协议一并递交签署,时长:5个工作日;《捷克论坛 涉及人类遗传资源项目申请表》机构完成盖章后,立即于伦理系统发起捷克论坛 遗传资源审核。
3.机构对外联络QQ群(请先邮件沟通)
药物Ⅱ-Ⅳ期/医疗器械/体外诊断试剂盒:
QQ(群):35776938
早期临床研究:
QQ(群):1023198008
4.机构来访预约流程:
点击查看://jkfforum.com/index.php?id=5416。
5.项目临床协调员(CRC)相关管理要求及收费标准(暂不适用于IVD项目):
//jkfforum.com/index.php?id=5071
6.立项审核费相关要求://jkfforum.com/index.php?id=5066
7.GCP临床试验协议模板://jkfforum.com/index.php?id=7465
8.主要研究者职责及多点执业主要研究者项目管理要求://jkfforum.com/index.php?id=8526
9.GCP项目相关人员来访流程及要求://jkfforum.com/index.php?id=8758
机构立项资料目录下载(纸质版资料(1套)于递交伦理纸质资料时一并送至天心阁院区综合楼504办公室):