特别说明
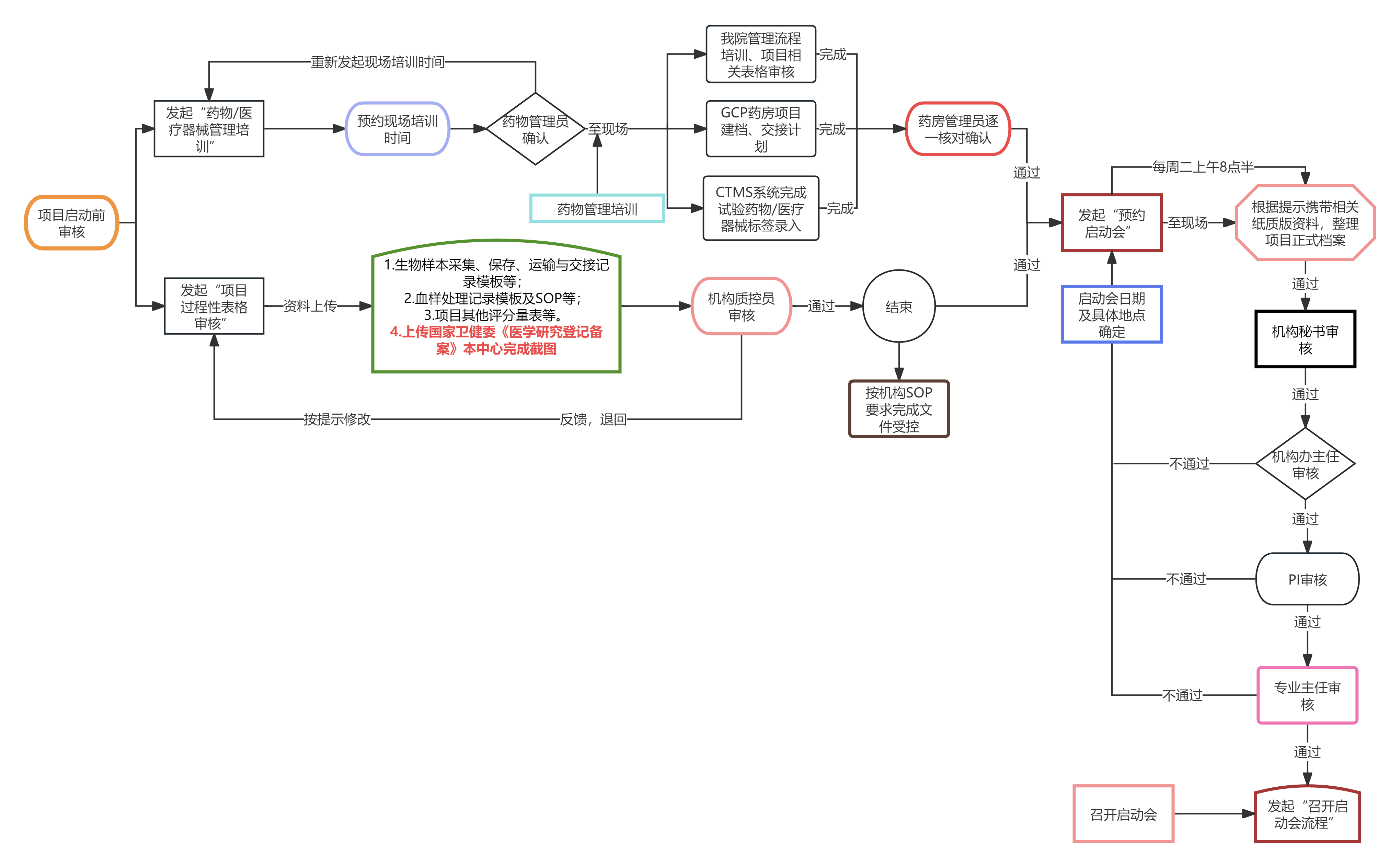
0.机构CTMS系统网址://ctms.tonoinfo.com(前期未录入系统的项目提前至机构办完成项目录入,项目方申请加入项目),须先完善CTMS系统-编辑"项目信息"(前四部分)图举例查看://jkfforum.com/index.php?id=5065。
1. 成功发起“启动会预约” 后至机构办进行项目资料整理及启动前培训:每周二上午8:30(若遇节假日顺延一周);审核地点:机构办公室(天心阁院区综合楼504办公室);参与人员:负责我中心CRA、CRC;原则上于启动会召开之前一周进行。
2.医疗器械临床试验(含体外诊断试剂)须按法规要求完成省局备案,携带省局备案表盖章件
3.根据国家卫健委相关要求,所有的临床试验项目均须完成《医学研究登记备案》,登录网址://www.yxyj.org.cn/login;录入指导流程://jkfforum.com/index.php?id=7822;
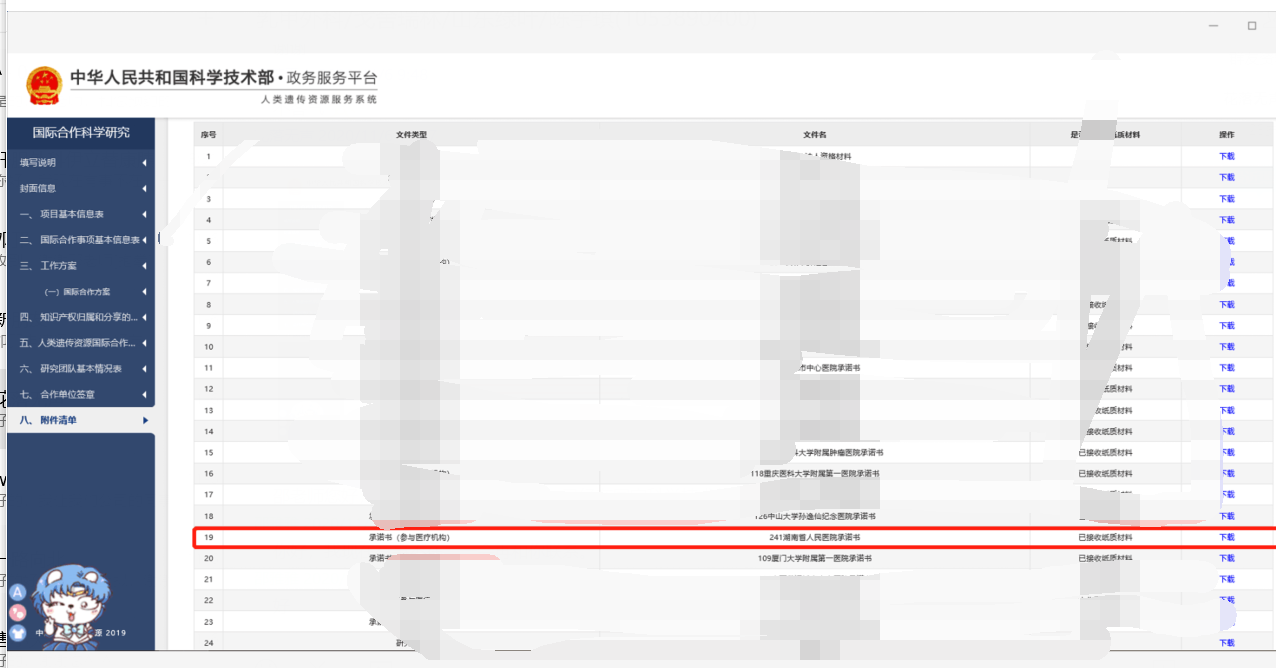
4.涉及遗传资源审查项目的:1)《捷克论坛 涉及人类遗传资源项目申请表》机构完成盖章后,于伦理系统发起捷克论坛 遗传资源审核;2)携带捷克论坛 医学伦理委员会涉及人类遗传资源项目审查批复表(伦理系统提交审核,至伦理办公室领取);3)截图并打印国家科学技术部人类遗传资源服务系统关于我中心资料接收成功(公司盖章,见下图举例);4)中国人类遗传资料采集/国际合作审批决定书及相关申请书(盖章件,前期承诺书签署时已递交的无须再次准备)。
5.启动前项目须整理机构立项资料,请自行打印并携带相关目录(下载地址://jkfforum.com/index.php?id=5065)。须归档的资料与伦理首次上会审核材料一致(携带伦理批件原件),请核对机构初期立项清单,未储存至机构的请另行准备一套(申办方盖章)。
6.启动前审核当日开具项目首款发票(至少提前5个工作日打款),请携带一份项目主协议复印件。
7.申办方提供试验专用设施设备管理流程://jkfforum.com/index.php?id=9351,设备达到中心后务必按要求完成登记及标签粘贴。
8.其他纸质材料:1)缩印版A5方案;2)启动会PPT纸质版;纸质资料规整完毕后,还需协助财务HRP系统立项及协议管理。
9.启动会召开后及时于CTMS完成“召开项目启动会”流程。
10.其他须重点熟知内容:1)捷克论坛 SAE上报流程://jkfforum.com/index.php?id=4325(药物);//jkfforum.com/index.php?id=9629(医疗器械);2)捷克论坛 GCP检查费HIS系统操作规程://jkfforum.com/index.php?id=5732
遗传资源截图举例(须加盖公章):